Résultats de l'essai clinique GDNF de Bristol

Le 27 février 2019 les résultats tant attendus de l'essai clinique de phase II sur le GDNF ont été publiés.
Le
GDNF (ou facteur neurotrophique dérivé de lignées de cellules gliales)
est une protéine que notre corps produit naturellement pour nourrir et entretenir les cellules. Des
recherches précliniques approfondies ont suggéré que cette protéine aidait particulièrement les neurones dopaminergiques - un groupe de
cellules du cerveau qui sont atteintes de la maladie de Parkinson.
Les
résultats de cet essai clinique de phase II suggèrent que le traitement
proposé a bien eu un effet sur le cerveau (basé sur des données d’imagerie), mais
les méthodes d’évaluation clinique n’indiquent malheureusement aucun effet
significativement différent entre le groupe traité et le groupe placebo.
Dans l'article d'aujourd'hui, nous examinerons ce qu'est le GDNF, nous passerons en
revue les recherches précédentes sur cette protéine, nous discuterons des
résultats de la dernière étude et nous allons examiner ce qui se va se passer ensuite.
Soyez donc averti que cela va être un article plutôt long !
|
Tout a commencé en 1991.
George HW Bush était à mi-mandat de sa présidence, un groupe de rock appelé Nirvana publiait son deuxième album ('Nevermind') et le film «Terminator 2» d'Arnold Schwarzenegger le film le plus rentable de l'année.
 Source: Stmed
Source: Stmed Mais dans la ville de Boulder (Colorado), on faisait une découverte qui changerait à jamais la recherche sur le Parkinson.
En 1991, les Dr Leu-Fen Lin et Frank Collins, tous deux chercheurs dans une petite société de biotechnologie appelée Synergen , ont isolé une protéine qu'ils ont appelée facteur neurotrophique dérivé des cellules gliales , ou GDNF.
Et en 1993, ils ont partagé leur découverte avec le monde entier dans cette publication:
 Titre: GDNF: facteur neurotrophique dérivé de lignées de cellules gliales pour les neurones dopaminergiques du cerveau moyen.
Titre: GDNF: facteur neurotrophique dérivé de lignées de cellules gliales pour les neurones dopaminergiques du cerveau moyen. Auteurs: Lin LF, DH Doherty, Lile JD, Bektesh S, Collins F.
Journal: Science, 21 mai 1993; 260 (5111): 1130-2.
PMID: 8493557
Pour les non-initiés parmi vous, lorsque les futurs historiens écriront l'histoire de la maladie de Parkinson, il n'y aura pas de plus grande saga scientifique que celle du GDNF.
En fait, dans toute l'histoire de la médecine, il existe peu de traitements expérimentaux qui on rendu les gens plus excités, divisés, passionnés et prosélytes que le GDNF.
Si vous voulez suivre l'histoire de ce «médicament miracle» préparez vous pour un voyage en montagnes russes .
Qu'est-ce que le GDNF?
le GDNF est le facteur neurotrophique dérivé des cellules gliales.
Décomposons cela :
Les cellules gliales sont considéré comme des cellules assurant la maintenance dans le cerveau. Alors que les neurones sont considérés comme les éléments essentiels de la fonction neurologique - transmission de messages et support de la mémoire - les cellules gliales forment l'intendance et veillent à ce que les neurones soient bien protégés et correctement nourris.
Il existe différents types de cellules gliales, notamment les astrocytes, les oligodendrocytes et la microglie. Chaque type de cellule a une fonction spécifique : la microglie, par exemple constitue les cellules immunitaires résidentes du cerveau qui contrôlent la santé des neurones, tandis que les oligodendrocytes fournissent aux neurones une enveloppe protectrice (appelée gaine de myéline) qui contribue également à accélérer la signalisation des neurones.
Les astrocytes fournissent des nutriments aux neurones et veillent à ce que l'environnement entourant les neurones soit équilibré et favorable. Les cellules gliales sont absolument essentielles au fonctionnement normal du cerveau.
Voila pour la partie «cellules gliales» du facteur neurotrophique dérivé des cellules gliales. Passons maintenant à la première partie.
Les facteurs neurotrophiques (neurotrophes = grec: neurone - nerf; trophikós - se rapportant aux aliments) sont des produits chimiques qui nourrissent les neurones et favorisent leur croissance. Il existe de nombreux types de facteurs neurotrophiques, certains ayant des effets plus bénéfiques sur certains types de neurones et pas d'autres. Le GDNF est l'un de ces facteurs neurotrophiques.
Les Dr Leu-Fen Lin et Frank Collins (que j'ai mentionnés ci-dessus) ont isolé le GDNF à partir d'une culture cellulaire de cellules gliales de rat - d'où le nom: facteur neurotrophique dérivé des cellules gliales.
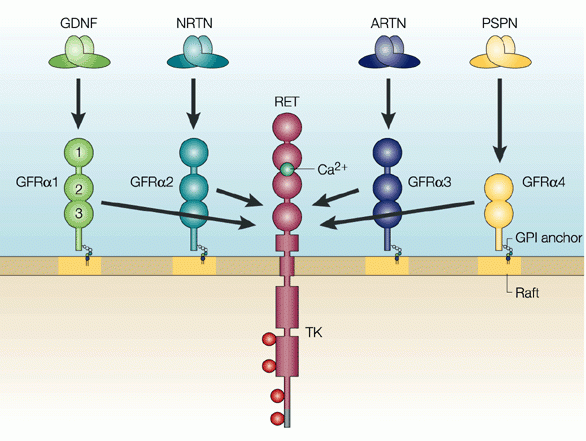
Le GDNF appartient à une famille plus large de facteurs neurotrophiques.
Et il y a trois autres membres de cette famille (appelés neurturin, persephin et artemin - cela ressemble aux Trois Mousquetaires!) qui ont également démontré des effets positifs sur les neurones dopaminergiques en train de mourir.
L'effet positif / neuroprotecteur de ces facteurs neurotrophiques agit via une série de «récepteurs» situés à la surface externe des cellules. Les récepteurs sont des molécules situées à la surface des cellules, qui attendent que des protéines spécifiques se développent et s'y lient. Lorsque celà arrive, le récepteur devient activé, et va pouvoir déclancher une cascade d'actions biochimiques à l'interieur de la cellule.
Il existe des récepteurs spécifiques à chacun des membres de la famille du GDNF et, lorsqu'ils sont activés, ils activent une autre protéine de surface appelée RET.
Le proto-oncogène Ret (en abrégé RET) est un récepteur de la tyrosine kinase, c'est-à-dire une molécule de surface cellulaire qui initie des signaux à l'intérieur de la cellule après la liaison des récepteurs de surface. L'activation de RET entraîne la croissance et la survie des cellules.
Les neurones dopaminergiques de notre cerveau possèdent la plupart des récepteurs de la famille du GDNF et beaucoup de RET.
Le GDNF exerce son effet neuroprotecteur sur les neurones dopaminergiques en se liant à son récepteur, qui active le RET ( Vous trouverez ici une revue scientifique très complète de la biologie du GDNF en accès libre).
Combien de recherches ont été menées sur le GDNF dans la maladie de Parkinson?
BEAUCOUP!
Le GDNF doit être l'un des composés les plus étudiés pour une utilisation thérapeutique potentielle dans la maladie de Parkinson, car les premières données générées étaient très impressionnantes.
[Et c'est là que commence notre voyage en montagnes russes…]
Un an après le rapport original GDNF de Lin et Collins, les premiers rapports sur les propriétés neuroprotectrices du GDNF dans des modèles animaux de la maladie de Parkinson ont commencé à être publiés ( cliquez ici , ici et ici pour lire ces premiers rapports), et encore un an après, le premier rapport d’effets bénéfiques chez des primates non humains a été publiés ( Cliquez ici pour en savoir plus à ce sujet).
Et il est important de comprendre que ces résultats ont été reproduits plusieurs fois de manière indépendante ( Cliquez ici , ici et ici pour quelques exemples préliminaires). Il existe de nombreuses recherches sur tous les aspects du GDNF dans des modèles de la maladie de Parkinson ( Cliquez ici pour lire une revue scientifique en OPEN ACESS sur ce sujet).
[…A partir d'ici les montagnes russes se dirigent vers les hauteurs … ]
À la suite de toutes ces données positives, de nombreux membres de la communauté de recherche sur la maladie de Parkinson ont été extrèmement enthousiaste que les docteurs Lin et Collins soient tombés sur ce «remède miracle» tant recherché pour la maladie de Parkinson.
Dés 1994, la société de biotechnologie Synergen a été racheté par la société pharmaceutique Amgen, qui a ensuite détenu les droits de GDNF et son utilisation dans la maladie de Parkinson.

Sentant qu'ils détenaient un traitement potentiellement très efficace contre la maladie de Parkinson, Amgen commença rapidement à mettre en place des essais cliniques pour évaluer si les effets neuroprotecteurs du GDNF se traduiraient aussi chez l'homme.
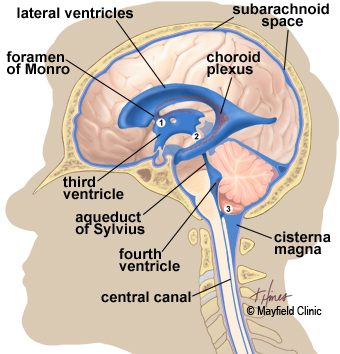
Entre juillet 1996 et avril 1999, 50 personnes atteintes de la maladie de Parkinson à un stade avancé participaient à un essai clinique, où un cathéter implanté dans la tête permettait d'accéder au système ventriculaire du cerveau.
Le système ventriculaire est un espace de votre cerveau (en périphérie, mais également avec des cavités internes) qui est rempli de liquide céphalo-rachidien - le liquide nourricier dans lequel baigne votre cerveau.
En insérant ce tube dans le système ventriculaire puis en injectant du GDNF, les chercheurs d'Amgen espéraient que le GDNF pénétrerait dans le cerveau et se répandrait dans les neurones dopaminergiques.
En effet, le GDNF ne peut pas être administré par voie orale car il ne traverse pas la barrière hémato-encéphalique - une membrane protectrice entourant le cerveau.
Cependant, les résultats de l’approche par voie ventriculaire ont rapidement montrés que cette méthode de traitement n’était pas idéale:

Titre: Essai randomisé à double insu sur le facteur neurotrophique dérivé de la lignée cellulaire gliale (GDNF) dans la MP.
Auteurs: Nutt JG, Burchiel KJ, Comella CL, Jankovic J, Lang AE, Laws ER Jr, Lozano AM, Penn RD, Simpson RK Jr, Stacy M, Wooten GF; Groupe d’étude ICV GDNF.
Journal: Neurologie. 14 janvier 2003; 60 (1): 69-73.
PMID: 12525720
La voie d'administration ventriculaire était défectueuse car le GDNF ne pouvait pas pénétrer très profondément dans le cerveau et avait donc un effet très limité. Pire encore parce que le liquide céphalo-rachidien permet l’accès à la moelle épinière et à d’autres régions du système nerveux central, de nombreux effets secondaires ont été rapportés chez les 38 participants ayant reçu du GDNF, notamment une hyponatrémie, des nausées, des vomissements et des paresthésies (sensation piquante des nerfs périphériques).
Les effets secondaires ont conduit Amgen à interrompre prématurément l’étude - et, malheureusement, ce ne sera pas la dernière fois qu’Amgen interromprait un essai GDNF.
[Les montagnes russes du GDNF plongent depuis les hauteurs vertigineuses initiales]
À ce stade, Amgen a apparemment mis le médicament de coté. À leur crédit cependant, il faut noter que cette société a mis le GDNF à la disposition des chercheurs souhaitant travailler avec ce dernier, mais il faudra attendre encore deux ans avant que d’autres humains en soient injectés.
Alors qu'est-ce qui s'est passé ensuite?
Au cours de ces années, Amgen a été approché par plusieurs groupes de chercheurs intéressés par la réalisation d'un essai clinique du GDNF sur la maladie de Parkinson. La société a finalement accepté
de fournir le médicament à une équipe de recherche de l'hôpital Frenchay de Bristol (Royaume-Uni).
Dans cette petite étude clinique, le GDNF a été injecté directement dans le cerveau, dans une zone appelée putamen . Les neurones dopaminergiques du cerveau résident dans une zone appelée la substantia nigra, près de la base du cerveau, mais projettent leurs branches (ou axones) sur plusieurs autres zones, y compris le putamen, où ils libèrent la majeure partie de leur dopamine. .
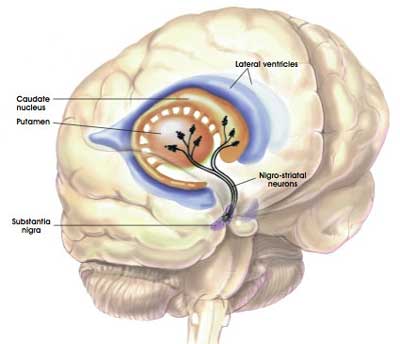
Les projections des neurones à la substantia nigra dopamine et la localisation du putamen. Source: MyBrainNotes
ls ont recruté 5 personnes atteintes de la maladie de Parkinson à un stade avancé et ont implanté de minuscules tubes dans le putamen, ce qui permettrait de pomper le GDNF dans cette région.
Et qu'ont trouvé les résultats de cet essai?
Les résultats de cette petite étude de phase I étaient plutôt remarquables.
[Le rollercoast repart vers l'avant]
Et ils ont estomaqué le monde de la recherche sur le Parkinson lors de leur publication en 2003:
 Titre: Infusion directe de facteur neurotrophique dérivé de la lignée cellulaire gliale dans la maladie de Parkinson.
Titre: Infusion directe de facteur neurotrophique dérivé de la lignée cellulaire gliale dans la maladie de Parkinson. Auteurs: Gill SS, Patel NK, Hotton GR, O'Sullivan K, McCarter R, Bunnage M, DJ Brooks, Svendsen CN, Heywood P.
Journal: Nat Med. 2003 mai; 9 (5): 589-95.
PMID: 12669033
Dans cette étude, les chercheurs ont traité les 5 participants avec du GDNF pendant un an. Les résultats de l'étude ont révélé que le traitement au GDNF avait pour résultat:
- une amélioration de 39% de la motricité hors médication (selon l'échelle d'évaluation unifiée de la maladie de Parkinson (UPDRS)
- une amélioration de 61% de la perception des sujets sur leur capacité à mener leurs activités quotidiennes.
- une réduction de 64% des dyskinésies induites par les médicaments (et elles n'ont pas été observées en dehors des médicaments)
- aucun effet secondaire clinique grave (aucun des problèmes signalés dans la première étude)
Et puis bien sûr, il y a les vidéos.
Les vidéos?
Ceci est une vidéo de certains des patients impliqués dans la première étude pilote du GDNF. Comme vous le verrez, la différence entre les images avant et après est plutôt frappante:
(Si vous avez du son, vous pouvez entendre Tom Isaacs et le Dr Stephen Gill parler du GDNF)
Et l'effet du traitement au GDNF a semblé avoir des effets à long terme
chez ces individus, comme l'a suggéré une étude de suivi de deux ans: Titre: Infusion intraputaménale de facteur neurotrophique dérivé de lignées de cellules gliales dans la MP: étude de résultats d'une durée de deux ans.
Auteurs: Patel NK, M Bunnage, Plaha P, Svendsen CN, Heywood P, Gill SS.
Journal: Ann Neurol. 2005 février; 57 (2): 298-302.
PMID: 15668979
Dans cette étude, les mêmes 5 patients ont présenté une amélioration de 57% et 63% de leurs sous-scores de la motricité hors-médicaments et de leurs activités de la vie quotidienne (échelle d'évaluation de la maladie de Parkinson unifiée) après 2 ans de traitement.
Les chercheurs ont également publié une étude de cas portant sur un patient de l’essai, suggérant que les effets positifs du GDNF avaient toujours un impact trois ans après que le médicament n’était plus administré ( Cliquez ici pour en savoir plus sur ce rapport). Il y avait aussi une analyse post mortem du cerveau d'un participant indiquant la germination de fibres de dopamine dans le putamen ( Cliquez ici pour plus d'informations).
C'est vraiment incroyable! Alors qu'est-ce qui s'est passé ensuite?
[Le rollercoast arrive à un autre sommet… ]
L’étude clinique de phase I sur le GDNF présentait un problème majeur: il s’agissait d’une étude ouverte.
Les participants à l'étude et les médecins chargés de l'étude savaient qui prenait le médicament. L'étude n'était pas aveugle, ce qui ouvre la porte au potentiel d'un important effet placebo (plus de détails ci-dessous).
Une reproduction indépendante des résultats de l’étude était nécessaire et a été publiée en 2007:
 Titre:
Facteur neurotrophique dérivé des lignées de cellules gliales
intraputaménales unilatérales chez les patients atteints de la maladie
de Parkinson: réponse à 1 an de traitement et à 1 an de sevrage
Titre:
Facteur neurotrophique dérivé des lignées de cellules gliales
intraputaménales unilatérales chez les patients atteints de la maladie
de Parkinson: réponse à 1 an de traitement et à 1 an de sevrage Auteurs: Slevin JT, DM Gash, CD Smith, Gerhardt GA, Kryscio R., Chebrolu H., Walton A., Wagner R., Young AB.
Journal: J Neurosurg. 2007 avril; 106 (4): 614-20.
PMID: 17432712
Dans cette étude de phase I, 10 personnes atteintes de la maladie de Parkinson ont été implantées unilatéralement avec un tube pour administrer du GDNF au putamen. Cela signifie que seul un côté du cerveau était traité avec du GDNF. Mais après 12 mois de traitement, les participants s'étaient améliorés de 42 et 38% dans les états OFF et ON selon le score UPDRS total.
[Attention, les montagnes russes culminent ici]
Après 12 mois de traitement, les participants ont été retirés du GDNF (le promoteur a délibérément arrêté le traitement en fonction d'autres événements - voir ci-dessous), mais ils ont été évalués pendant 12 mois supplémentaires. Les bénéfices du traitement par GDNF ont été complètement perdus 9 à 12 mois après l'arrêt de la perfusion de GDNF (les scores UPDRS étaient revenus à leurs niveaux initiaux).
[Les montagnes russes re-découvrent la gravité et se dirigent vers un autre plongeon…]
Plus important encore, 7 des 10 participants avaient apparemment développé des anticorps anti-GDNF.
Que sont les anticorps?
Les anticorps sont des protéines en forme de Y que le système immunitaire produit naturellement et en continu pour identifier tout élément de l'organisme autre que soi (c'est-à-dire qui ne fait pas partie de votre corps, pensez aux virus, aux bactéries, etc.).

Des anticorps monoclonaux. Source: Astrazeneca
Les anticorps agissent comme des signaux d'alerte pour le système immunitaire.
Lorsque des anticorps se lient à quelque chose, ils alertent le système immunitaire pour qu’il enquête et l'élimine. La liaison d'un anticorps à une protéine peut également empêcher la protéine de remplir sa fonction. Heureusement, ce développement des anticorps n'a pas provoqué de réaction immunitaire chez les participants, ce qui aurait pu amener le corps à attaquer une source de GDNF - étrangère ou naturelle.
Cela ne semble pas être un bon point cependant. Qu'est-ce qui s'est passé ensuite?
[La gravité reprend complètement la main sur les montagnes russes…]
Parallèlement à cette petite étude de phase I, Amgen a également lancé un essai clinique en double aveugle sur le GDNF avec 34 participants. En double aveugle, les chercheurs et les participants ne savaient pas qui recevait du GDNF ou un traitement de contrôle. La procédure a utilisé une pompe très différente pour délivrer le GDNF dans le cerveau (par rapport à celle utilisée dans l'étude de Bristol), et certains ont suggéré que cela aurait pu contribuer aux résultats de cette étude.
Quel a été le résultat de cette étude?
En juin 2004, Amgen a annoncé que son essai clinique évaluant l’efficacité du GDNF dans le traitement de la maladie de Parkinson avancée avait montré un effet biologique (basé sur l’imagerie cérébrale au Fluorodopa PET), mais n’avait démontré aucune amélioration clinique (par rapport au traitement par placebo) après six mois de traitement. utiliser ( Cliquez ici pour lire le communiqué de presse).
[… Et les montagnes russes sont maintenant en chute libre…]
Plus tard cette année-là (en septembre), Amgen arrêta complètement l’étude. Ils ont cité deux raisons:
- Les données précliniques de primates non humains traités pendant six mois dans le groupe ayant reçu la dose la plus élevée (suivies d'une période de sevrage thérapeutique de trois mois) montraient une perte significative de neurones dans une région du cerveau appelée cervelet (qui est impliquée dans le mouvement de coordination)
- Ils avaient détecté des anticorps chez 18 des 34 participants à l'étude (dont 4 avaient développé une activité neutralisant la protéine - Cliquez ici pour en savoir plus à ce sujet).
 Titre:
Essai randomisé contrôlé sur la perfusion de facteurs neurotrophiques
dérivés de lignées de cellules gliales intraputaménales dans la maladie
de Parkinson.
Titre:
Essai randomisé contrôlé sur la perfusion de facteurs neurotrophiques
dérivés de lignées de cellules gliales intraputaménales dans la maladie
de Parkinson. Auteurs: Lang AE, Gill S, Patel NK, Lozano A, Nutt JG, Penn R, DJ Brooks, Hotton G, Moro E., Heywood P, Brodsky MA, Burchiel K, Kelly P, Dalvi A, Scott B, Stacy M, Turner D, Wooten VG, Elias WJ, Lois ER, Dhawan V, Stoessl AJ, Matcham J, Coffey RJ, Traub M.
Journal: Ann Neurol. 2006 mars; 59 (3): 459-66.
PMID: 16429411
Ce qui suivit fut un chapitre pas très joli de l'histoire du GDNF.
Amgen a refusé de permettre aux participants à l’étude de continuer à utiliser le GDNF lorsqu’ils en ont fait la demande. L'affaire est allée devant les tribunaux (deux procès en 2005), mais les juges ont décidé en faveur d'Amgen.
[… Toujours en chute libre]
Pendant que tout cela se passait, d'autres molécules membres de la famille des facteurs neurotrophiques GDNF étaient en cours de test dans des modèles de Parkinson, en particulier de Neurturin. Une grande partie de ces recherches utilisait une autre formulation basée sur la thérapie génique .
Qu'est ce que la thérapie génique?
La thérapie génique est une approche de traitement expérimental qui consiste à traiter la maladie de Parkinson avec un ADN plutôt qu'avec des médicaments.
La thérapie génique consiste à insérer un ou plusieurs morceaux d’ADN dans une cellule, ce qui permettra à celle-ci de produire des protéines qu’ils ne produisent pas habituellement. L’introduction de l’ADN se fait généralement à l’aide de virus génétiquement modifiés dont tous les composants pathogènes ont été éliminés, ce qui nous permet d’utiliser le virus comme système d’administration efficace. Les virus, de par leur nature même, sont efficaces pour infecter les cellules. Par conséquent, si nous supprimons les composants responsables de la maladie, il ne reste plus qu'un système très efficace pour libérer un médicament au bon endroit.
[Les montagnes russes pourraient-elles montrer des signes de remontée?]
Une société de biotechnologie appelée Ceregene était à la pointe de cette approche et elle a lancé des essais cliniques de son produit de thérapie génique appelé CERE-120.

L’étude de phase I suggérant que le traitement était sans danger et bien toléré, la société a donc lancé un essai clinique de phase II ( cliquez ici pour en savoir plus sur cette étude), et les résultats ont été publiés dans 2012 ( Cliquez ici pour les lire) avec un ensemble de résultats à long terme publiés en 2015:
 Titre:
Distribution génique de neurturine au putamen et à la substantia nigra
dans la maladie de Parkinson: essai contrôlé, à double insu et randomisé
Titre:
Distribution génique de neurturine au putamen et à la substantia nigra
dans la maladie de Parkinson: essai contrôlé, à double insu et randomisé Auteurs: Warren Olanow C, Bartus RT, Baumann TL, Facteur S, Boulis N, Stacy M, Turner DA, Marques W, Larson P, Starr PA, Jankovic J, Simpson R, Watts R, Guthrie B, Poston K, Henderson JM. , Stern M, Baltuch G, CG Goetz, Herzog C, Kordower JH, Alterman R, Lozano AM, Lang AE.
Journal: Ann Neurol. 2015 août; 78 (2): 248-57.
PMID: 26061140
Dans cette étude, entre décembre 2006 et novembre 2008, 58 patients de 9 sites de recherche répartis aux États-Unis ont été recrutés pour participer à l’essai. Les participants ont été assignés au hasard pour recevoir soit des injections bilatérales dans le cerveau d'un virus AAV contenant l'ADN de la neurturine, soit une opération fictive. Mais après une étude de 15 à 24 mois, les investigateurs n'ont trouvé aucune différence entre les participants.
Tous ces développements (et d'autres encore) ont laissé de nombreuses personnes dans la communauté de recherche sur le Parkinson pensant que les facteurs neurotrophiques ne fonctionneraient pas pour cette maladie.
[ les montagnes russes se sont complètement arrêtées au fond du creux]
Et peut-être que la situation serait restée la même, sans les efforts acharnés de certains particuliers qui ont mis au point l’essai clinique de phase II GDNF de Bristol.
Qui étaient ces individus 'obstinés'?
L'un d'eux était Tom Isaacs.
En 1996, alors qu'il n'avait que 27 ans, Tom, alors géomètre basé à Londres, a été diagnostiqué avec Parkinson. Après avoir surmonté le choc initial, Tom a prius en main sa situation et est devenu un militant très engagé. Il a d'abord parcouru le littoral britannique pour recueillir des fonds et sensibiliser le public à la maladie de Parkinson.

Son livre, “Shake well before use“ (« Bien agiter avant utilisation » non traduit en francais), traite de ce voyage et de son adaptation à la vie avec la maladie de Parkinson (c'est une lecture que je recommande pour ceux qui lisent l'anglais). À mi-chemin de sa marche épique, cependant, les résultats de l’essai clinique de phase I sur le GDNF ont été publiés et ont fait sensation. Un ami a dit à Tom: "Tu peux arrêter de marcher, ils ont trouvé le remède"
Tom a néanmoins terminé son treck et à son retour à Londres, il a fondé (avec trois autres personnes) le Cure Parkinson's Trust . Il était un défenseur passionné du GDNF et l’un des moteurs de l’essai de phase II du GDNF de Bristol.
Le professeur Stephen Gill, qui était l'investigateur principal de l'étude clinique de phase I et qui fournissait les résultats initiaux du GDNF, était un autre partisan enthousiaste de l'approche GDNF. Le professeur Gill était également l'inventeur du système d'administration innovant utilisé dans les essais cliniques.
Anecdote amusante: la première fois que Tom Isaacs a rencontré le professeur Gill, c'était lors de sa promenade côtière en 2002, au moment où Tom passait devant Bristol. Après avoir traversé le pont de Severn, ils se sont rencontrés à la station-service Severn View, ont acheté une tasse de café, se sont assis et ont parlé de GDNF.
Bryn Williams, fondateur de Funding Neuro , est un troisième personnage qui mérite d'être mentionné dans l'histoire de l'essai clinique de phase II du GDNF de Bristol. Funding Neuro est un organisme caritatif qui finance des recherches qui accéléreront le traitement des maladies neurologiques. Bryn a été un ardent défenseur de l’essai clinique Bristol GDNF.
Alors, quel était l'essai de Bristol GDNF?
En janvier 2010, alors que les essais cliniques de thérapie génique étaient en cours pour les facteurs neurotrophiques, Amgen a cédé sous licence les droits de GDNF à une société appelée Medgenesis .

Et les gens à Medgenesis étaient très désireux de voir débuter un autre essai clinique dans la maladie de Parkinson
En collaboration avec Cure Parkinson's Trust et Bryn Williams, le professeur Gill a contacté Parkinson's UK et proposé de mener une autre étude clinique à double insu de phase II sur le GDNF chez des personnes atteintes d'une maladie de Parkinson avancée.
Parkinson UK a convenu que c'était une bonne idée et a également accepté de financer l'essentiel de l'étude.
La nouvelle étude a débuté en 2012 et comprenait une nouvelle méthode révolutionnaire de traitement, consistant à implanter très précisément des tubes dans le cerveau grâce à un dispositif robotique (système développé par le professeur Gill et une société appelée Renishaw ). Ces implants sont reliés à un autre tube qui aboutit à un petit port placé juste derrière l'oreille.
Source: Medium (un très bon article de Parkinson's UK traitant de l'étude)
Et c’est via ce port que le traitement GDNF (ou placebo) a été administré aux participants à l’étude.
Je parle souvent de la «valeur ajoutée» des essais cliniques comme élément important de tout essai et ce système de distribution dans le cerveau en est un exemple fantastique : Cette même technologie est maintenant utilisée dans l’essai clinique en cours sur la maladie de Parkinson, mené en Finlande et en Suède par la CDNF (voir plus bas à ce sujet), ainsi que dans de nombreux essais cliniques en oncologie (pour les cancers du cerveau). En ce qui concerne les résultats de l’essai GDNF, les résultats de l’étude ont déjà eu d’énormes avantages pour la communauté médicale au sens large.
Cela semble très intéressant. Les résultats de l'étude ont donc été publiés aujourd'hui?
Oui, ces résultats sont publiés dans la prestigieuse revue 'Brain':
 Titre:
Essai randomisé sur le facteur neurotrophique dérivé de lignées de
cellules gliales intraputaménales et intermittentes dans la maladie de
Parkinson
Titre:
Essai randomisé sur le facteur neurotrophique dérivé de lignées de
cellules gliales intraputaménales et intermittentes dans la maladie de
Parkinson Auteurs: Whone A, Luz M, Boca M, Woolley M, L Mooney, Dharia S, J Broadfoot, Cronin D, Schroers C, Barua NU, Longpre L, Barclay CL, Boiko C, Johnson GA, Fibiger HC, Harrison R, Lewis O, G Pritchard, Howell, M, Irving, D, Johnson, S, Kinch, C, Marshall, Lawrence, Binder, Sossi, V, Stoessl, AJ, Skinner, P, Mohr, E, Gill, SS.
Journal: Brain, 2019: 142; 512–525
PMID: 30808022 (Ce rapport est OPEN ACCESS si vous souhaitez le lire)
Dans cette étude, les chercheurs ont commencé par sélectionner des personnes afin d'identifier celles qui correspondait le mieux aux objectifs de l'étude. Entre octobre 2012 et avril 2015, 196 personnes de tout le Royaume-Uni ont été examinées. Parmi ceux-ci, 41 personnes ont été sélectionnées pour participer à l'étude. Les enquêteurs ont commencé l'étude avec un petit groupe pilote de participants (6 personnes) afin d'évaluer l'innocuité de la technique chirurgicale et l'administration du GDNF. Une fois optimisé, les 35 participants restants ont reçu la procédure chirurgicale. Tous les participants ont ensuite été randomisés et traités pendant 40 semaines soit avec du GDNF soit avec un traitement placebo ( Cliquez ici pour en savoir plus sur les détails de l’essai).
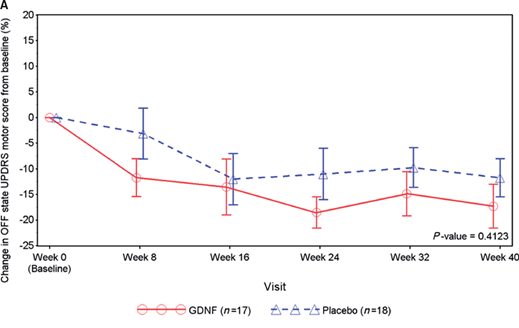
Le critère d'évaluation principal de cet essai était le pourcentage de changement par rapport à la mesure initiale dans le score moteur UPDRS (partie III) dans l'état OFF après 40 semaines de traitement en double aveugle. Celà permettait de quantifier le degré d’amélioration chez les participants entre le début et la fin de l’étude. Des évaluations cliniques ont été effectuées au départ, à 8 semaines, 16 semaines, 24 semaines, 32 semaines et 40 semaines.
Les critères d'évaluation secondaires de l'étude comprenaient:
- Pourcentage de changement entre le score moteur UPDRS et le temps de référence entre le début et la fin de la 40e semaine dans l'état ON
- Le pourcentage de changement par rapport aux valeurs de base des résultats des activités de la vie quotidienne dans les systèmes UPDRS dans les états OFF et ON
- Les scores UPDRS parties I et IV
- Le changement dans les annotations quotidiennes du journal de la maladie.
Les résultats de l'étude suggèrent qu'il n'y avait aucune différence dans les performances OFF ou ON au point de 40 semaines entre le groupe traité par GDNF et le groupe placebo. Comme vous pouvez le voir sur le graphique ci-dessous, les deux groupes ont commencé à s'améliorer peu de temps après le début du traitement, et les deux groupes ont continué à le faire tout au long des 40 semaines de l'étude. Une diminution du score UPDRS suggère une amélioration de la performance motrice des participants, et la ligne rouge (traitement au GDNF) et la ligne bleue (groupe placebo) sur le graphique présentent un tragectoire à la baisse.
Certes, la ligne rouge est plus basse que la ligne bleue, mais cela n’est pas statistiquement significatif.
Comment pouvons-nous expliquer cela?
Il peut y avoir différentes interprétations, mais je pencherai en faveur d'une réponse placebo.
Qu'est-ce qu'une réponse placebo?
Une réponse placebo se produit quand on présente une réaction à un traitement, pour lequel il n'y a aucune raison pharmacologique. Il n'y a aucune raison biologique pour laquelle le traitement par placebo a entraîné une amélioration du groupe de contrôle, mais ils l'ont fait.
De plus, aucun des paramètres secondaires ne présente de différence significative entre les deux groupes.
C'est vraiment pas bon, n'est ce pas?
C'est regrettable, mais ce n'est pas la fin du monde.
Plus important encore, il existe des résultats très intéressants dans les résultats globaux.
Tel que?
Les répondeurs.
Que?
Chaque essai de médicament a des individus qui répondent mieux que les autres dans l'étude, et c'était le cas égalemet dans cette étude. Certains membres du groupe traité par GDNF ont mieux répondu que d’autres au traitement.
Mais surtout, cette «différence de réponse» indique une différence entre le GDNF et le groupe placebo.
Vous voyez, lorsque les chercheurs ont examiné le nombre de participants ayant obtenu une amélioration supérieure à 10 points sur le score OFF UPDRS, 9 personnes ont eu cette réponse dans le groupe GDNF, mais aucune dans le groupe traité par placebo. Bien que de nombreuses personnes aient eu une réponse placebo dans le groupe contrôle / placebo, aucune d’entre elles n’a eu une réponse aussi importante que celle des répondeurs GDNF.
Et vous pouvez voir que ce sont les graphiques ci-dessous. À gauche (groupe traité par GDNF), il y a 9 barres rouges au-delà de la ligne de répondeur de plus de 10 points, mais à droite (bleu), il n'y en a pas.
 Source: cerveau
Source: cerveau Intéressant. Y a t il d'autres points d'intérêt?
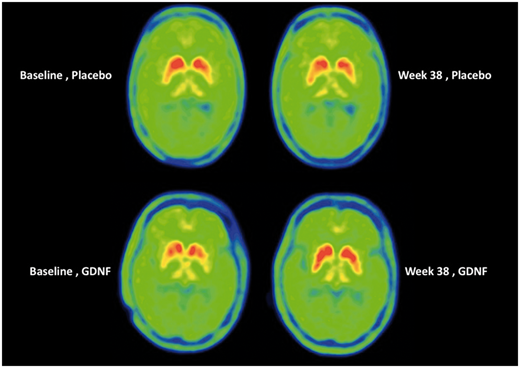
Plutot, oui: Les résultats d'imagerie cérébrale.
Regardez l'image ci-dessous:
Chacun des 4 cercles verts représente une vue par le dessus du cerveau. Les régions rouge / jaune sont le putamen de chaque côté du cerveau. Plus la coloration rouge est intense, plus le niveau d'activité de la dopamine est important. Maintenant, si vous regardez les deux cerveaux dans la rangée du haut, ce sont des images du même individu (image de base à gauche et image de 40 semaines à droite). Notez la réduction subtile de la coloration rouge dans l'image de droite (40 semaines) par rapport à l'image de gauche (référence) (en particulier autour des extrémités inférieures du putamen). Cette perte de coloration rouge suggère une réduction de l'activité de la dopamine. Les images de la rangée supérieure proviennent d’un individu traité avec le placebo au cours de l’étude.
Portez maintenant votre attention sur la rangée inférieure d'images cérébrales et notez l' augmentation de la coloration rouge dans l'image de la main droite (point temporel de 40 semaines). J'espère que vous conviendrez que par rapport à l'image de base (à gauche), il y a beaucoup plus de coloration rouge sur l'image de 40 semaines (à droite). Cette différence suggère une augmentation de l'activité de la dopamine.
Que pourraient signifier les résultats d'imagerie cérébrale?
Cela suggère que le GDNF a bien eu un effet biologique dans le cerveau - le traitement faisait quelque chose. Quel est cette action ? Celà doit encore être déterminé.
Il y a en effet trois explications possibles:
1. une augmentation de la production de la dopamine dans les fibres de dopamine restantes
2. une Augmentation du nombre de fibres à dopamine
3. une augmentation des autres types de fibres neuronales pouvant absorber la lévodopa
Les trois explications sont possibles. Mais nous n'avons actuellement aucun moyen de tester - à part répéter l'expérience avec une gamme plus large d'évaluations d'imagerie cérébrale.
Mais j'espère que vous conviendrez que c'est une partie très intéressante des résultats et qu'elle mérite certainement une enquête plus approfondie.
Intéressant. Y a t'il encore autre chose à retirer de cette étude?
Il y a un autre détail vraiment intéressant dans les résultats de cette étude : pas d'anticorps.
À la fois dans les parties en double aveugle et en ouvert de l’étude, les chercheurs n’ont jamais détecté d’anticorps anti-GDNF dans le sang analysé des participants à aucun moment de cette étude.
(REMARQUE: Après les 40 semaines d’étude à double insu, il y avait encore 40 semaines d’évaluation en ouvert dans lesquelles tous les participants recevaient du GDNF - Cliquez ici pour lire le rapport de cette phase de l’étude).
Alors qu'est-ce qui se passe ensuite?
Eh bien, cela ne semble pas être la fin des approches de traitement par GDNF ou neurotrophique pour la maladie de Parkinson.
Il y a beaucoup de discussions en cours pour savoir s'il devrait y avoir un autre essai pour suivre les données des répondants et les résultats de l'imagerie cérébrale. On se demande si la dose de GDNF était suffisamment élevée pour avoir un effet - la dose utilisée était 3,5 fois plus petite que dans les études historiques sur l'administration de doses continues (120 µg contre 420 µg), pour des raisons de sécurité fondées sur les résultats sur les primates. De plus, certains se demandent si l'étude était suffisamment longue.
Et tandis que ces discussions sur le GDNF se poursuivent, nous devrions bientôt avoir des nouvelles concernant une autre étude clinique sur les facteurs neurotrophiques qui utilise le même système d'administration que l'étude sur le GDNF de Bristol. L' essai clinique du facteur neurotrophique dopaminergique (CDNF) en cours de réalisation en Finlande et en Suède devrait s'achever cette année, et nous espérons avoir des nouvelles de cette étude. Cette étude est menée par la société de biotechnologie Herantis .
L'étude de phase I / II évalue l'innocuité et la tolérabilité de la CDNF chez les personnes atteintes de la maladie de Parkinson. Semblable à l’étude de phase II sur le GDNF, le médicament est injecté directement dans le cerveau à l’aide d’un système canulaire implanté. Un tiers des participants ont reçu des perfusions mensuelles de placebo et deux tiers des perfusions mensuelles de doses moyennes ou élevées de CDNF pendant 6 mois ( Cliquez ici pour en savoir plus sur cet essai). Une étude d'extension de cet essai a récemment été lancée ( Cliquez ici pour en savoir plus sur cette étude).
Les résultats préliminaires de cette étude ne seront disponibles que l'année prochaine, mais les données de sécurité / tolérabilité de cet essai ont été présentées lors de la réunion Alzheimer / Parkinson 2019 en mars.
En plus de cette étude, un essai clinique de thérapie génique GDNF a été lancé en Californie. Cette étude devait à l'origine être menée sur la côte est des États-Unis, mais elle a été déplacée vers la côte ouest et devrait débuter à l'été. Cette étude impliquera l'injection dans le cerveau d'un virus AAV qui infectera les cellules avec l'ADN nécessaire à la production de cellules provoquant le GDNF dans une région particulière du cerveau pour commencer à produire du GDNF ( Cliquez ici pour en savoir plus sur cet essai) . Nous garderons une oreille attentive aux informations relatives à cette étude.
De plus, il existe également une société appelée Genecode , qui développe des « petites molécules qui imitent le GDNF et qui déclenchent la signalisation neurotrophique dans les neurones dopaminergiques » ( Source ). Il sera intéressant de voir ce qui se passe avec cette entreprise.

Ouf, effectivement c'était un long article! Donc, résumons. Qu'est-ce que tout cela veut dire?
Une minute. Il y a autre chose dont nous devons vraiment discuter.
Il n'y a aucun moyen d'éviter le fait qu'il y avait une énorme réponse au placebo dans le groupe contrôle / traité au placebo dans cette étude. Comme je l'ai mentionné ci-dessus, une réponse placebo se produit lorsque l'on présente une réaction à un traitement, pour laquelle il n'y a aucune raison pharmacologique. Il n'y avait aucune raison biologique pour laquelle le groupe traité par placebo aurait dû s'améliorer, mais c'est le cas. Ces participants allaient vraiment mieux.
Certaines personnes pourraient penser que la procédure chirurgicale crée une forte probabilité d'effet placebo. D'autres évoqueront l'excellence des soins cliniques dispensés sur un site de recherche unique (déterminé à maximiser la rétention des patients) susceptible de contribuer à cette situation.
Bien que je sois ouvert aux théories ou aux idées sur ce qui aurait pu provoquer la réponse au placebo, je suis plutôt partisan d’une réponse plus humaine: cet essai clinique a commencé avec de grandes attentes de la part de toutes les personnes impliquées (les participants et les coordinateurs).
Et ce potentiel de réponse placebo me préoccupe profondément alors que nous commençons à allouer des ressources supplémentaires à de vastes essais cliniques pour des traitements desquels la communauté des malades et des chercheurs attend déjà beaucoup (pensez par exemple à l'essai clinique Exenatide). La réponse au placebo est considérée comme un problème dans la maladie de Parkinson ( Cliquez ici pour lire un ancien article de SoPD à ce sujet), et l’étude de Bristol GDNF en fournit un bel exemple.
Nous devons réfléchir sérieusement à la gestion des attentes à l'avenir.
Alors qu'est-ce que tout cela signifie?
J'espère que l'on me pardonnera d'utiliser l'analogie des montagnes russes dans cet article, mais j'ai suivi la saga du GDNF depuis le début de mon doctorat en 2002. Le laboratoire dans lequel j'ai effectué ma recherche doctorale a été l'un des nombreux à fournir des données précliniques sur le GNDF, et donc j'ai toujours ressentit beaucoup d'excitation à propos de ce nouveau composé étonnant.
J'espere que nous vous avons avons fourni un bon aperçu de l'histoire de GDNF et une description objective des résultats de ce dernier essai cliniques dans cet article (et nous serions heureux d'être corrigé pour tous les détails que nous pourrions avoir omis).
Mais comprenez nous bien : il y a un sentiment de déjà-vu que je ne peut pas m’empêcher d'avoir à propos de toute ce travail de recherche : Nous sommes déjà passé par ces montagne russe émotionnelles plusieurs fois.
Il y aura nécessairement beaucoup de discussions après la publication de ces résultats, mais j'espère que contrairement à de nombreux essais cliniques infructueux qui ont été glissés sous le tapis et oubliés (40% des études cliniques sur Parkinson ne publient pas leurs résultats - Cliquez ici pour plus d'informations sur cette statistique plutôt accablante), j'espère que l'essai clinique GDNF de Bristol sera un vrai déclencheur de changement.
Il faut que la communauté scientifique reconnaisse que notre processus d’essais cliniques doit être soigneusement repensé et adapté. Une analyse très objective de l’étude Bristol GDNF est nécessaire.
Il nous faut impliquer tous les parties du processus des essais cliniques. Patients, cliniciens, tout le monde. Une conversation constructive sur la façon dont nous pouvons améliorer les choses et faire mieux. Il nous faut apprendre de cette expérience et utiliser ces connaissances pour planifier de meilleurs essais cliniques, idéalement plus réussis.

NOTE DE L'ÉDITEUR
Cet article est basé sur une traduction du travail du docteur Simon Stott directeur de recherche au Cure Parkinson’s Trust, avec son aimable autorisation.
Une première version en Anglais a été publiée le 29 fevrier 2019 sur son blog Science of Parkinson

All of the material on this website is licensed under a
Creative Commons Attribution 4.0 International License
Les informations fournies sur ce site Web ont un but informatif et éducatif. En aucun cas, elles ne devraient être considérées comme un conseil médical. Gardez bien en tête que ces informations sont fournies par des chercheurs et non par des praticiens médicaux.
Toute action basée sur ce qui a été lu sur ce site web relève de la seule responsabilité du lecteur. N'oubliez pas que toute modification d'un traitement médical doit d’abord faire l’objet d’une discussion avec un professionnel de la santé qualifié, connaissant bien vos antécédents médicaux.
Certaines
des informations présentées dans cet article pourraient être
source d'inquiétude: parlez-en à votre médecin avant de considérer
qu'elles puissent s'appliquer à votre propre situation ou à celle d'un
de vos proche, et consultez-le avant de tenter de
modifier un traitement existant.
En outre, bon nombre des sociétés pharmaceutiques ou de biotechnologies mentionnées dans nos articles sont des sociétés cotées en bourse. Certaines personnes pourraient imaginer pouvoir tirer un gain financier à partir des informations sur les progrès de recherche en cours avant qu'elles soient largement diffusées. Les documents présentés sur cette page ne sont évidemment pas des conseils financiers. Toute investissement entrepris par le lecteur sur la base de la lecture de ce document relèverai de sa seule responsabilité.
Et bien sur, aucune des sociétés citées n’a demandé que ces informations soit publiées, et l’auteur n’a pas eu de contact particulier avec ces sociétés au sujet des information rapportées.
En outre, bon nombre des sociétés pharmaceutiques ou de biotechnologies mentionnées dans nos articles sont des sociétés cotées en bourse. Certaines personnes pourraient imaginer pouvoir tirer un gain financier à partir des informations sur les progrès de recherche en cours avant qu'elles soient largement diffusées. Les documents présentés sur cette page ne sont évidemment pas des conseils financiers. Toute investissement entrepris par le lecteur sur la base de la lecture de ce document relèverai de sa seule responsabilité.
Et bien sur, aucune des sociétés citées n’a demandé que ces informations soit publiées, et l’auteur n’a pas eu de contact particulier avec ces sociétés au sujet des information rapportées.
Cet article a été produit uniquement à des fins éducatives.
Déclaration de conflit d’intérêt :
Il est important que vous sachiez que l' auteur de la version initiale de cet article est un employé de la Cure Parkinson's Trust et le président du bureau de l'association Parkinson UK . Ces deux organisations - Cure Parkinson's Trust et Parkinson's UK - ont financé l’essai clinique de phase II de Bristol sur le GDNF dans la maladie de Parkinson. Ni ces organisations ni l'équipe GDNF de Bristol Hosptial n'ont néanmoins demandé à ce que cet article soit écrit. Cet article a été fourni par l'auteur uniquement dans le but de partager ce qu'il considère être une histoire intéressante de recherche médicale.
La bannière de l'article d'aujourd'hui provient du Cure Parkinson's Trust.