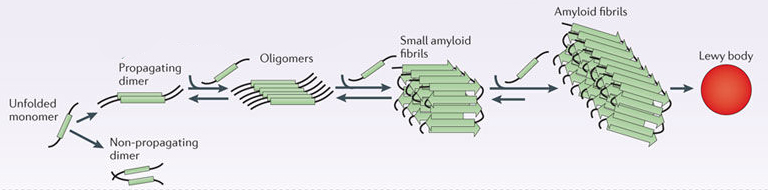
De nouvelles perspectives sur le gène PINK
Le système immunitaire est notre principale ligne de défense contre un monde plein d’agents pathogène. C'est une machinerie compliquée qui fait un travail fantastique pour nous garder en sécurité et en bonne santé.
Cependant ce sytème de défense peut se dérégler. Une étude récente a suggéré qu'un gène associé à la maladie de Parkinson pourrait être associé à une réaction excessive du système immunitaire en réponse à l'infection par un microbe ou un empoisonnement alimentaire.
Plus précisément, les souris dépourvues du gène PINK1 avaient littéralement une «réaction auto-immune» à l’infection - c’est-à-dire que le système immunitaire a commencé à attaquer les cellules saines du corps - tandis que les souris normales (avec les gènes PINK1 intacts) se sont rétablies de l’infection.
Dans l'article d’aujourd’hui, je vous propose d'explorer ces nouveaux résultats de recherche et de discuter des raisons pour lesquelles nous pourrions avoir besoin de repenser le rôle du gène PINK.
|
Source: Huffington Post
Un groupe de chercheur canadiens a récemment publié l'article suivant :
 Title: Intestinal infection triggers Parkinson’s disease-like symptoms in Pink1−/− mice
Title: Intestinal infection triggers Parkinson’s disease-like symptoms in Pink1−/− miceAuthors: Matheoud D, Cannon T, Voisin A, Penttinen AM, Ramet L, Fahmy AM, Ducrot C, Laplante A, Bourque MJ, Zhu L, Cayrol R, Le Campion A, McBride HM, Gruenheid S, Trudeau LE, Desjardins M.
Journal: Nature, 2019 Jul 17 [Epub ahead of print].
PMID: 31316206
Les chercheurs canadiens qui ont mené cette étude ont voulu explorer les raisons pour lesquelles les variations génétiques du segment d’ADN appelé PINK1 augmentent le risque de développer la maladie de Parkinson.
Qu'est-ce que PINK1?
Environ 10 à 15% des cas de Parkinson sont associés à des variations particulières de l’ADN qui rendent les personnes vulnérables au développement de la maladie (Cliquez ici pour en savoir plus sur la génétique de Parkinson). Certaines de ces variations concernent des régions spécifiques de l’ADN (appelées gènes) qui fournissent les instructions pour la fabrication de protéines particulières.
Il existe actuellement plus de 20 gènes appelés «gènes PARK», car les variations génétiques au sein de ces gènes rendent les personnes plus vulnérables au développement de la maladie de Parkinson.
Un de ces gènes PARK s'appelle PINK1 (ou PARK6).
PINK1 est impliqué dans un certain nombre de fonctions, mais il a été le plus étudié dans le contexte de la mitophagie.
Qu'est-ce que la mitophagie?
La mitophagie est le processus cellulaire d'élimination des mitochondries anciennes / endommagées.
Pour les non-initiés, les mitochondries sont les centrales énergétiques de chaque cellule. Ils aident à garder les lumières allumées. Sans eux, la fête est finie et la cellule meurt.
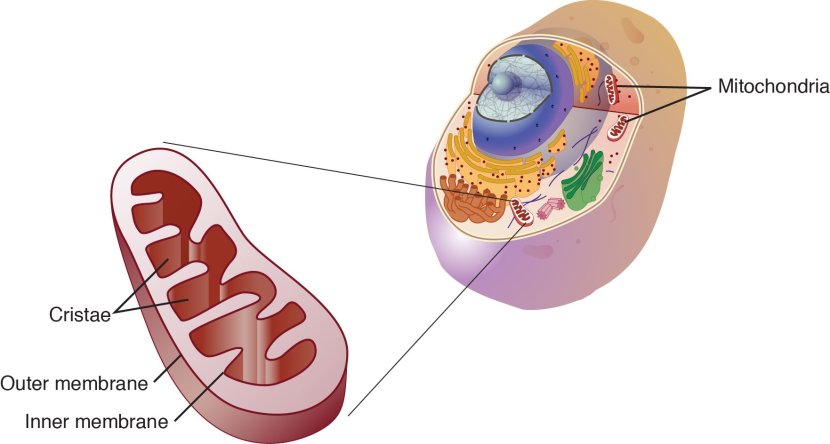
Les mitochondries dans la cellule. Source: NCBI
Vous vous souviendrez peut-être de votre cours de biologie au lycée que les mitochondries sont de minuscules objets de forme oblongues dans la cellule. Ils convertissent les nutriments contenus dans les aliments en adénosine triphosphate (ou ATP). L'ATP est le carburant sur lequel fonctionnent les cellules. Compte tenu de leur rôle critique de l’approvisionnement en énergie, les mitochondries sont nombreuses (certaines cellules en comptent des milliers) et très bien organisées au sein de la cellule : elles se déplacent là où elles sont nécessaires.
Comme vous et moi et toutes les autres choses de la vie, les mitochondries ont une date de péremption.
À mesure que les mitochondries vieillissent et s'usent (ou sont endommagées) avec le temps, la cellule les recyclera via un processus appelé mitophagie (un mélange des mots mitochondrie et autophagie qui constitue le système d'élimination des déchets de chaque cellule).
Quel rôle joue la protéine PINK1 dans le processus de mitophagie?
PINK1 agit comme une sorte de poignée à la surface des mitochondries. Dans les mitochondries saines et normales, la protéine PINK1 se fixe à la surface des mitochondries et elle est lentement absorbée jusqu'à ce qu'elle disparaisse complètement de la surface et se dégrade. Cependant, dans les mitochondries agées ou abimées, ce processus est inhibé et PINK1 commence à s'accumuler à la surface externe de la mitochondrie. Ce serait comme si de nombreuses poignées s'accumulaient à la surface des mitochondries.
Et il existe une deuxième protéine associée à Parkinson, appelée PARKIN, qui est un drapeau qui tient à la poignée PINK1. Alors qu’il est exposé à la surface des mitochondries, PINK1 commence à saisir la protéine PARKIN. Cet appariement indique à la cellule que cette mitochondrie particulière n’est pas saine et doit être éliminée. Le couplage déclenche le processus menant au développement d’une structure appelée phagophore, qui engloutit les mitochondries et mène finalement à son élimination en toute sécurité.

PINK1 and PARKIN in normal (right) and unhealthy (left) situations. Source: Hindawi
IEn l’absence de protéines PINK1 ou PARKIN normales, il n’existe pas de poignée à la surface des mitochondries anciennes / endommagées et elles commencent à s’accumuler : c'est le stress mitochondrial : les mitochondries ne sont pas éliminés de manière appropriée et la cellule tombe malade et finit par mourir.
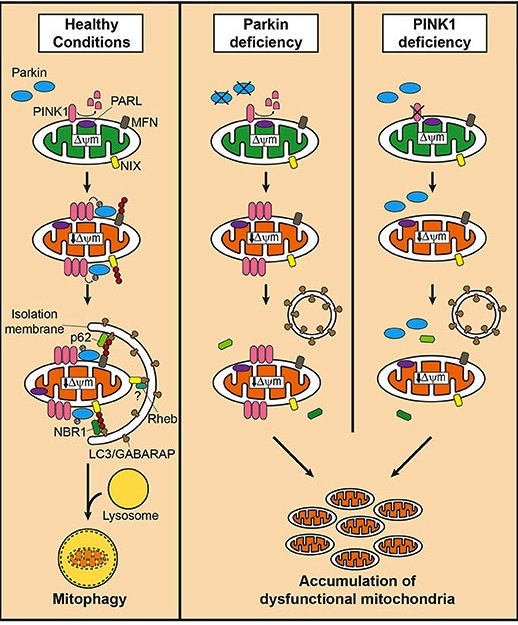 Mitophagy. Source: Frontiersin
Mitophagy. Source: Frontiersin
Les personnes présentant des mutations génétiques particulières dans les gènes PINK1 ou PARKIN sont susceptibles de développer une forme précoce de Parkinson (généralement avant l’âge de 40 ans - encore une fois, veuillez noter l’âge). On a longtemps cru que l'élimination disfonctionnelle (et l'accumulation) d'anciennes mitochondries était l'une des raisons pour lesquelles ces personnes développaient la maladie à un âge aussi précoce.
Mais récemment, il a été rapporté que des souris avec des mutations PINK1 ou PARKIN avaient des niveaux basaux normaux de mitophagie (Cliquez ici pour en savoir plus à ce sujet).
Les chercheurs ont donc réévalué cette idée de mitophagie et ont commencé à explorer de nouvelles possibilités.
Qu'ont-ils découvert?
Dans l’étude que nous examinons aujourd’hui, les chercheurs ont pris de jeunes souris génétiquement modifiées pour ne pas produire le gène de la protéine PINK1 et les ont infectées à dessein avec une bactérie appelée Citrobacter rodentium.
Citrobacter rodentium est très similaire à la bactérie E. coli, une source d'intoxication alimentaire courante chez l'homme, et elle provoque une inflammation de l'intestin des souris.
Les chercheurs ont commencé par infecter des souris normales (avec une copie fonctionnelle du gène PINK1) avec Citrobacter rodentium, et ces souris ont été en mesure de gérer cette infection sans problème.
Mais pour les souris sans PINK1 c'était une autre histoire. Et c'est là où ce travail de recherche devient intéressant:
Les souris PINK1 ont commencé à développer lentement des symptômes similaires à ceux de Parkinson.
Plus précisément, ces souris infectées par Citrobacter rodentium (sans PINK1) présentaient une densité diminuée dans les branches des neurones dopaminergiques dans une région du cerveau appelée le striatum (où les neurones dopaminergiques libèrent l'essentiel de leur dopamine). La perte de branches de neurones dopaminergiques et dopaminergiques dans le striatum est la marque de Parkinson. Et cela conduit progressivement à des troubles moteurs (inhibition du mouvement) que les chercheurs ont également observés chez ces souris PINK1 infectées.
Il est intéressant de noter que ces problèmes moteurs chez les souris pourraient être inversés par un traitement par L-DOPA.
Les souris sont-elles en permanence atteintes de la maladie de Parkinson? Non. Curieusement, les caractéristiques de comportement ressemblant à la maladie de Parkinson n'étaient qu'un effet transitoire. Les souris infectées (sans PINK1) sont revenues à la normale environ 12 mois après l'infection.
Quoi?!? Comment les chercheurs expliquent-ils cela?
Pour mieux comprendre pourquoi ces souris PINK1 ont commencé à avoir des problèmes, les chercheurs ont bien examiné la réponse du système immunitaire. Il y a quelques années, ces mêmes scientifiques avaient publié ce rapport:
 Title: Parkinson’s Disease-Related Proteins PINK1 and Parkin Repress Mitochondrial Antigen Presentation.
Title: Parkinson’s Disease-Related Proteins PINK1 and Parkin Repress Mitochondrial Antigen Presentation.Authors: Matheoud D, Sugiura A, Bellemare-Pelletier A, Laplante A, Rondeau C, Chemali M, Fazel A, Bergeron JJ, Trudeau LE, Burelle Y, Gagnon E, McBride HM, Desjardins M.
Journal: Cell, 2016 Jul 14;166(2):314-327.
PMID: 27345367
(cet article est accessible gratuitement en OPEN ACCESS si vous souhaitez le lire)
Dans cette étude plus ancienne, les chercheurs ont montré que PINK1 - et son partenaire PARKIN - inhibaient activement les réponses immunitaires induites par l’inflammation.
Et dans la nouvelle étude, ils ont constaté que, bien que le système immunitaire chez des souris normales faisait face à l'infection à Citrobacter rodentium de manière normale, les cellules immunitaires des souris sans PINK1 «sur-réagissaient», entraînant une «réaction auto-immune».
Qu'est-ce qu'une réaction auto-immune?
Une réaction auto-immune est une réponse immunitaire au sein d'un organisme contre ses propres cellules et tissus sains. De nombreuses maladies résultent d'une telle réponse immunitaire et sont appelées maladies auto-immunes.

Different types of autoimmune diseases. Source: DrJockers
Heureusement pour les souris sans PINK1, comme mentionné ci-dessus, elles sont progressivement revenues à la normale - le système immunitaire s'est calmé et la réaction auto-immune s'est atténuée.
Cela suggère-t-il que la maladie de Parkinson pourrait être une maladie auto-immune?
Certaines formes de la maladie de Parkinson pourraient bien être associées à un système immunitaire trop actif, et certaines preuves le corroborent. Par exemple une étude récente suggère que des «auto-anticorps» naturels (qui jouent un rôle important dans l'élimination et le blocage des protéines en circulation) sont plus faibles chez les personnes atteintes de la maladie de Parkinson que chez les sujets sains:

Title: Autoimmune antibody decline in Parkinson’s disease and Multiple System Atrophy; a step towards immunotherapeutic strategies.
Authors: Brudek T, Winge K, Folke J, Christensen S, Fog K, Pakkenberg B, Pedersen LØ.
Journal: Mol Neurodegener. 2017 Jun 7;12(1):44.
PMID: 28592329 Cet article est disponible également en OPEN ACCESS si vous souhaitez le lire.
Dans cette étude, les chercheurs ont prélevé des échantillons de sang sur 46 personnes atteintes de la maladie de Parkinson, 18 personnes souffrant d’atrophie multisystémique (une affection très semblable à la maladie de Parkinson) et 41 sujets de contrôle sains. Lorsqu’ils ont analysé le sang à la recherche d’autoanticorps ciblant la protéine alpha-synucléine, ils ont constaté une réduction des taux chez les personnes atteintes de la maladie de Parkinson par rapport aux témoins sains, et une diminution encore plus marquée chez les personnes souffrant d’atrophie multisystémique.
Les chercheurs ont conclu qu'une réduction des niveaux de ces anticorps anti-synucléine entraînait une augmentation du nombre d'alpha synucléine et la création d'un environnement potentiellement inflammatoire. Ils ont également proposé que les résultats fournissent une bonne justification pour tester des stratégies thérapeutiques à base immunitaire dirigées contre l'alpha synucléine pathologique (comme dans les essais cliniques Affiris et Prothena).
Un deuxième rapport récent suggérant une association entre la réponse auto-immune et Parkinson est basé sur une étude beaucoup plus large:

Title: Genome-wide Pleiotropy Between Parkinson Disease and Autoimmune Diseases
Authors: Witoelar A, Jansen IE, Wang Y, Desikan RS, Gibbs JR, Blauwendraat C, Thompson WK, Hernandez DG, Djurovic S, Schork AJ, Bettella F, Ellinghaus D, Franke A, Lie BA, McEvoy LK, Karlsen TH, Lesage S, Morris HR, Brice A, Wood NW, Heutink P, Hardy J, Singleton AB, Dale AM, Gasser T, Andreassen OA, Sharma M; International Parkinson’s Disease Genomics Consortium (IPDGC), North American Brain Expression Consortium (NABEC), and United Kingdom Brain Expression Consortium (UKBEC) Investigators.
Journal: JAMA Neurol. 2017 Jun 5. doi: 10.1001/jamaneurol.2017.0469.
PMID: 28586827
Dans cette étude, les chercheurs ont analysé l'ADN recueilli chez 138511 personnes d'origine européenne et ont identifié 17 nouveaux locus génétiques partagés entre Parkinson et une série d'affections auto-immunes (notamment le diabète de type 1, la maladie de Crohn, la colite ulcéreuse, la polyarthrite rhumatoïde, la maladie coeliaque). psoriasis et sclérose en plaques).
Selon cet article, des individus apparemment en bonne santé, mais porteurs de mutations génétiques qui les prédisposent à l’inflammation, pourraient également courir un risque accru de développer la maladie de Parkinson. PINK1 n’a pas été mentionné dans cette étude, mais la LRRK2 associée à la maladie de Parkinson (dont nous avons déjà parlé dans cet article précédent) était associée à la polyarthrite rhumatoïde, à la colite ulcéreuse et à la maladie de Crohn.
Il existe donc des preuves suggérant que certains cas de Parkinson peuvent être associés à une réaction auto-immune.
Ce qui est intéressant dans l'article que nous avons examiné aujourd’hui, c’est que les souris ont récupéré. Néanmoins, il ne faut pas oublier que ces souris sont hébergées dans des environnements presque stériles, et il faut se demander ce qui arriverait aux souris sans PINK1 si elles vivaient à l'état sauvage? Une exposition constante à des agents pathogènes de l’environnement entraînerait-elle un système immunitaire «excessivement réactif»? Et cela conduirait-il finalement à un état parkinsonien plus permanent? Ces questions doivent encore être examinées.
Mais des essais cliniques sont actuellement en cours sur l’utilisation de thérapies anti-inflammatoires dans le traitement de la maladie de Parkinson, qui pourraient s’avérer utiles compte tenu des résultats du rapport publié dans le post d’aujourd’hui. Par exemple, Inzomelid qui est un inhibiteur de NLRP3 en cours de développement par une société nommée Inflazome.
Cette société a récemment lancé des essais cliniques de phase I sur Inzomelid chez des personnes en bonne santé (cliquez ici pour en savoir plus sur cet essai), et envisage de commencer les tests chez les personnes atteintes de la maladie de Parkinson dans un avenir proche (cliquez ici pour lire un précédent article (en anglais) de SoPD sur ce sujet).
Alors Résumons nous : qu'est-ce que tout cela signifie?
Depuis longtemps, la protéine PINK1 associée à la maladie de Parkinson est associée au processus d’élimination des mitochondries (mitophagie) anciennes / endommagées. De nombreux efforts ont été déployés pour tenter de déterminer pourquoi les erreurs génétiques dans le gène PINK1 sont associées à l'apparition précoce de la maladie de Parkinson, et en quoi cela pourrait être lié au processus de la mitophagie.
Mais peut-être avons-nous chassé le mauvais lièvre, et que les réactions auto-immunes sont le mécanisme expliquant le fonctionnement de ce gène. Peut-être devons-nous repenser PINK?
Et en repensant ce que nous pensions savoir, nous identifierons certainement de nouvelles voies de recherche pour traiter la maladie Parkinson.
Cet article est basé sur le travail du docteur Simon Stott directeur de recherche au Cure Parkinson’s Trust, avec son aimable autorisation.

All of the material on this website is licensed under a
Creative Commons Attribution 4.0 International License
Les informations fournies sur ce site Web ont uniquement un but informatif et éducatif.En aucun cas, vous ne devriez les considéréer comme un conseil médical. Ces informations sont fournies par des chercheurs et non par des praticiens médicaux.
Toute action basée sur ce qui a été lu sur notre site - relève de la seule responsabilité du lecteur. N'oubliez pas que toute modification d'un traitement médical doit d’abord faire l’objet d’une discussion avec un professionnel de la santé qualifié, connaissant bien vos antécédents médicaux.
Certaines des informations présentées dans cet article pourraient être source d'inquiétude: parlez-en à votre médecin avant de considérer qu'elles puissent s'appliquer à votre propre situation ou à celle d'un de vos proche, et surtout, consultez-le avant de tenter de modifier un traitement existant.
En outre, bon nombre des sociétés pharmaceutiques ou de biotechnologies mentionnées dans cet article sont des sociétés cotées en bourse. Certaines personnes pourraient vouloir tirer un gain financier à partir des informations sur les progrès de recherche en cours avant qu'elles soient largement diffusées. Les documents présentés sur cette page ne doivent bien sur en aucun cas être considérés comme des conseils financiers. Encore une fois, toute action entreprise par le lecteur sur la base de la lecture de ce document relève de sa seule responsabilité.
Aucune des sociétés citées n’a demandé que ces informations soit publiées, et l’auteur n’a eu aucun contact direct avec ces sociétés au sujet des informations rapportées (et bien sur pas de rétribution ce qui va sans dire, mais va mieux en le disant) .